O
desenvolvimento da tabela periódica
A classificação dos elementos químicos: vários estudiosos
tentaram classificar os elementos químicos com critérios de acordo com cada
época. A intenção era tentar explicar as
transformações observadas na natureza. Com o desenvolvimento das teorias
atômicas foram formuladas novas ideias e várias tentativas foram e continuam
sendo feitas, originando a tabela periódica.
- Primeiras tentativas de organização: Como consequência dos
trabalhos de Dalton, surgiu a hipótese de que os elementos químicos estavam associados as suas massas atômicas.
Em 1817, o químico Johann W. Döbereiner observou relações numéricas entre
as massas atômicas de alguns elementos químicos em tríades, sendo a massa
atômica do elemento central a média aritmética das massas dos outros dois
elementos. Já em 1862 o geólogo Alexandre- Émile B. de Chancourtois apresentou
uma organização tridimensional dos elementos químicos, de modo que muitos
elementos químicos com propriedades semelhantes ficassem alinhados
verticalmente.
- Periodicidade e previsão: Em 1864, o químico
John A. R. Newlands observou que, ao dispor os elementos químicos conhecidos em
ordem crescente de massa atômica, a cada sete elementos químicos existiam
semelhanças em suas propriedades, sendo chamada de periodicidade, mas ainda
possuía falhas. O químico William Odling ao dispor os elementos químicos com
propriedades semelhantes na vertical, conseguiu acomodar um maior número dos
elementos conhecidos na época. Em cerca de 1870, o químico Mendeleev e Lothar
apresentaram de modo independente uma forma de organizar os elementos químicos
baseando-se nas massas atômicas, organizaram os elementos em ordem crescente de
massa atômica, mas Mendeleev se destacou por realizar previsões das
propriedades desses elementos: “As propriedades físicas e químicas dos
elementos químicos variam periodicamente quando aumenta a massa atômica”. As
ideias de Mendeleev estavam corretas.
A organização atual da tabela periódica
- A tabela periódica de Mendeleev possuía algumas inconsistências, que ficavam evidentes à medida que novos elementos químicos eram identificados e o conhecimento sobre a estrutura da matéria aumentava.
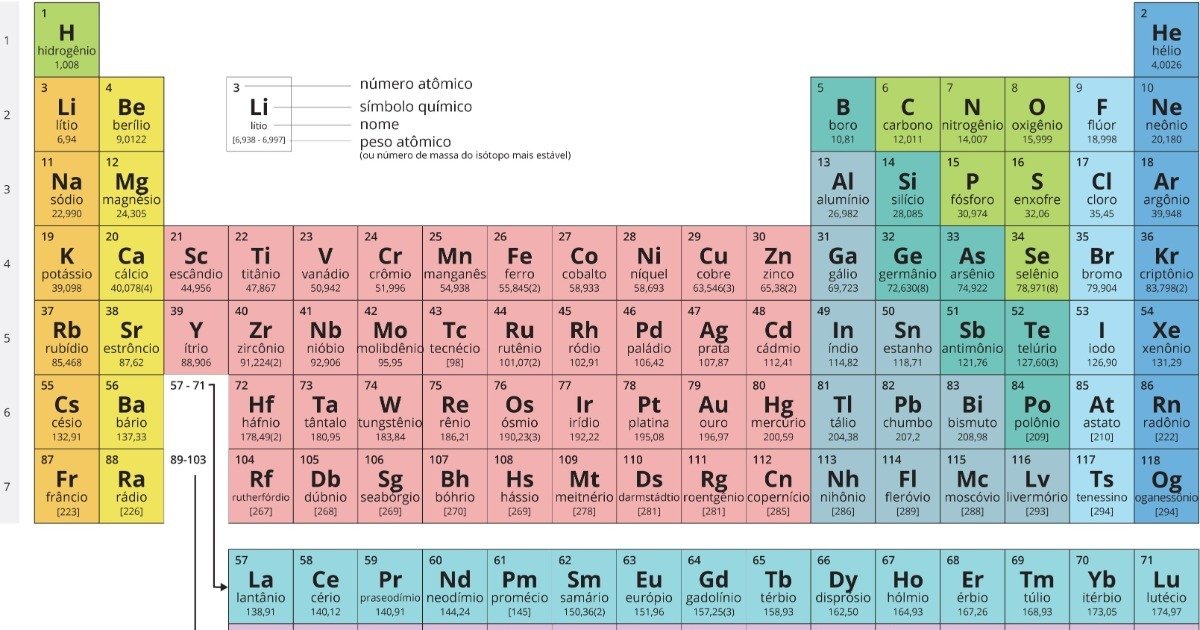
- A organização pelo número atômico: os elementos foram organizados em ordem crescente de número atômico.
- Representação do elemento químico na tabela periódico: todo elemento químico é representado por seu símbolo em um quadro e o nome do elemento químico é geralmente inserido logo abaixo do símbolo. No lado oposto ao número atômico fica a massa atômica.-> A massa atômica: é calculada com base na existência de diferentes isótopos dos elementos químicos, levando em consideração a distribuição dos isótopos na natureza.
- Grupos e períodos:
-> Grupos: também chamados de famílias, são linhas verticais da tabela.
-> Períodos: são linhas horizontais.
- Atualmente existem 18 grupos na tabela periódica e 7 períodos.
-> Grupo 1: o grupo dos metais alcalinos possui temperaturas de fusão e ebulição baixas em relação à maioria dos metais.
-> Grupo 2: o grupo dos metais alcalinoterrosos possui metais mais duros e têm maior temperatura de fusão que os metais alcalinos.
-> Grupo 16: o grupo dos calcogênios, termo que significa "geradores de cobre''.
-> Grupo 17: o grupo dos halogênios tem constituintes abundantes em sal.
-> Grupo 18: (grupo dos gases nobres) substâncias simples formadas por elementos químicos desse grupo são muito pouco reativas e, por isso, são compostas geralmente de átomos isolados.
- Metais e não metais:
- Elementos químicos naturais e artificiais:
-> O tecnécio foi o primeiro elemento químico artificialmente criado.
-Lantanídeos e actinídeos:
-> Lantanídeos: são elementos químicos com número atômico de 57 a71.
-> Actinídeos: são elementos químicos de número atômico de 89 a 103.
Propriedades periódicas
Elementos com propriedades semelhantes estão localizados no mesmo grupo da tabela periódica.
- Raio iônico: o raio dos íons crescem ao longo do grupo e diminuem ao longo do período, em ordem crescente de número atômico.
- Potencial de ionização ou Energia de ionização é a energia essencial para remover um elétron de um átomo na fase gasosa. Átomo no estado fundamental Átomo⁺ + e⁻ E = energia de ionização
- A energia de ionização em determinado período tende a aumentar à medida que cresce o número atômico e tende a diminuir com o aumento do número atômico em um mesmo grupo.
- A quantidade mínima de energia necessária para remover um elétron de um ânion gerando um átomo é chamada de afinidade eletrônica. A afinidade eletrônica indica a tendência do átomo em receber elétrons e formar ânions.



Nenhum comentário:
Postar um comentário