- O conceito de átomo:
- A teoria atômica de Dalton:
- A matéria é formada por pequenas esferas, maciças e indivisíveis denominadas átomos.
- Átomos iguais e com mesma massa representam um mesmo elemento químico.
- As substâncias são constituídas por um número fixo de átomos de seus elementos químicos.
-> Lei da composição constante: defendida por Louis Proust, estabelecia que a composição elementar de um composto era sempre a mesma independentemente de sua origem.
-> Lei da conservação das massas: apoiada por Antoine Lauren Lavoisier que acreditava na ocorrência de uma reação química, em um recipiente fechado, a massa total dos reagentes era igual à massa total dos produtos.
- A representação dos átomos e dos elementos químicos:
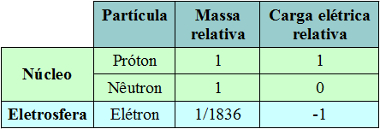
A identificação das partículas subatômicas
- A natureza elétrica da matéria;

- A identificação do elétron e o modelo atômico de Thomson:
- Por volta da segunda metade do século XIX, alguns cientistas, entre eles William Crookes, provaram que os gases quando submetidos a baixas pressões e altas voltagens, podiam se tornar condutores elétricos. Para realizar esses experimentos foi usado um tubo de raios catódicos, que consistia em um ampola de vidro com estruturas metálicas nas extremidades, denominadas eletrodos-um positivo chamado ânodo, e um negativo, denominado cátodo. Os eletrodos eram conectados a uma bateria e geravam alta voltagem dentro do tubo e a ampola tinha sua pressão interna menor por causa de uma bomba de vácuo. Quando a pressão de dentro do tubo ficava menor o gás era submetido a altas voltagens e começava a emitir luz. Se a pressão fosse menor a luz diminuía. Os cientistas passaram a acreditar que a luz se originava no cátodo e passaram a chamar de raios catódicos. John Thomson usou vários gases e eletrodos formados por diferentes metais, obtendo sempre os mesmos valores para a razão entre carga e massa. Esses resultados sugeriam que os raios catódicos eram originados sempre pelo mesmo tipo de partícula. O valor da carga foi estabelecido através de experimentos feitos por Robert Millikan. A massa das partículas era calculada e o valor encontrado era muito menor que o conhecido para os átomos, que posteriormente foram denominados elétrons e estariam presentes na estrutura de todo átomo. Thomson propôs um novo modelo de átomo para explicar os resultados experimentais observados. O elétron era considerado uma partícula subatômica. Então Thomson acreditou que o átomo seria constituído por uma esfera com carga positiva uniformemente distribuída, que se anulavam com as negativas. Descargas elétricas ou atrito poderiam arrancar elétrons ou inseri-los nos átomos que se transformariam nas partículas eletricamente carregadas chamadas de íons.
- O modelo atômico de Rutherford:

O átomo seria constituído por uma região central com carga elétrica positiva , muito pequena e densa, responsável pela maior parte de sua massa, denominada núcleo, ao redor do núcleo existiria um espaço vazio delimitado pela eletrosfera, região ocupada pelos elétrons que estariam orbitando o núcleo a uma grande distancia dele e, por serem negativos, seriam atraídos por ele.
-A estrutura do núcleo: poderia ser dividido em partículas ainda menores. A primeira identificada foi o próton, partícula com carga elétrica positiva proposta por Rutherford , assim o núcleo não seria uma esfera maciça, mas um conjunto de prótons. Outros experimentos constataram a existência do nêutron, partícula eletricamente neutra que já tinha sido prevista por Ruherford.
O átomo:
- Partículas subatômicas e número de massa:
A= número da massa.
P= prótons.
N= nêutrons.
Fórmula: A=p+n
- O número de prótons e os elementos químicos:
Ex:
6C12 (carbono-12).
6C13 (carbono-13).
6C14 (carbono-14).
- Formação de íons:
-> Cátion perde elétrons.
-> Ânion ganha elétrons.
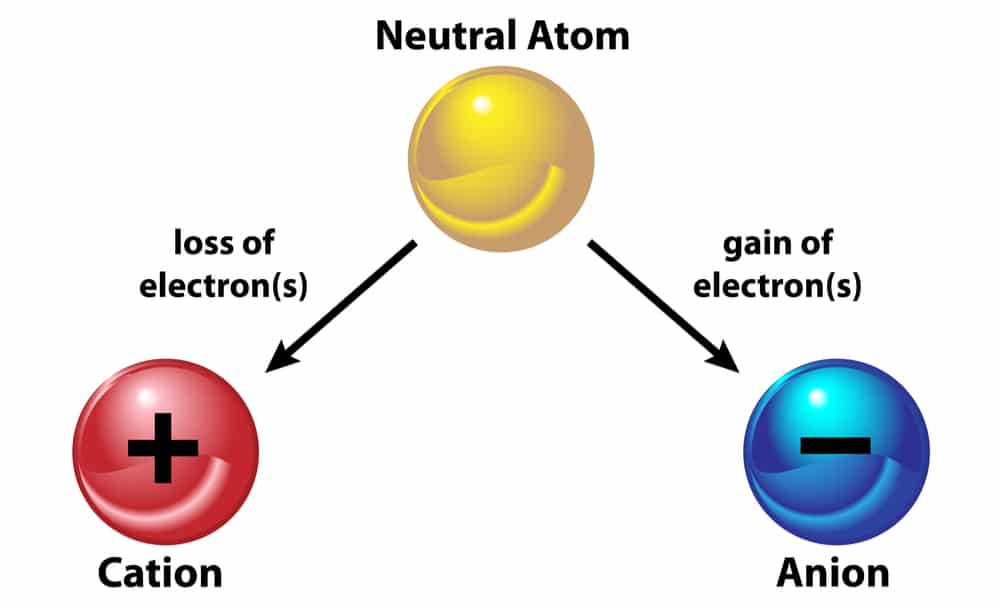
OBS: na notação de um íon utiliza o valor de sua carga à direita, na parte superior do símbolo.
Ex: N-3
- Classificação das substâncias:
- Composta: constituídas por dois ou mais elementos.
- Alotropia:
-> Os alótropos de carbono mais comuns são o grafite e o diamante, mas existem outros alótropos de carbono. São exemplos fulereno, nanotubo de carbono e diamante lonsdaleíta.
-> O enxofre possui muitas formas alotrópicas (S2, S4, S6). Dentre as mesmas se destacam o enxofre ortorrômbico, ou rômbico, e o enxofre monoclínico, ambas representadas por S8, mas agrupadas de formas diferentes.
->O oxigênio origina dois alótropos: o gás oxigênio (O2) e o gás ozônio (O3).
-> As formas de alotropia do fósforo mais conhecidas são o fósforo vermelho (P), que se forma quando o fósforo branco entra em radiação e o fósforo branco (P4 ) é muito reativo.
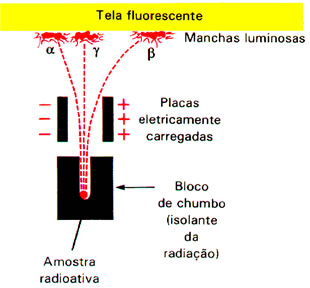 A cintilação originada a direita da tela formou uma radiação com carga negativa, já que foi atraída pelo polo positivo. A cintilação à esquerda formou-se por radiação com carga positiva, atraída pelo polo negativo.A massa da radiação de carga positiva era maior. A cintilação central foi originada por uma radiação eletricamente neutra, pois não sofreu nenhum desvio.
A cintilação originada a direita da tela formou uma radiação com carga negativa, já que foi atraída pelo polo positivo. A cintilação à esquerda formou-se por radiação com carga positiva, atraída pelo polo negativo.A massa da radiação de carga positiva era maior. A cintilação central foi originada por uma radiação eletricamente neutra, pois não sofreu nenhum desvio.
Aplicações tecnológicas da radioatividade
- As emissões radioativas são compostas de ondas eletromagnéticas ou de partículas de tamanhos diversos e diferentes níveis de energia, permitindo que exista diferentes níveis de interação entre a radiação e a matéria, por causa de fatores como a energia cinética da partícula ao ser emitida e as interações entre cargas elétricas. Por seu baixo poder de penetração, as partículas alfa são absorvidas pela camada mais externa da pele dos seres humanos e causam pequenos danos. Entretanto são extremamente perigosas quando inaladas ou ingeridas, pois no primeiro caso ocorre a irradiação, já no segundo ocorre a contaminação. As partículas beta podem penetrar cerca de 1 cm no corpo humano antes de serem interrompidas, ocasionando várias lesões. A radiação gama, muito energética, atravessa facilmente o corpo humano, interagindo com o DNA das células, causando várias doenças, como câncer. Todas as pessoas que ficam expostas a essa radiação devem usar equipamentos adequados e devem fazer exames periódicos específicos para verificar suas condições de saúde. A radioatividade natural é chamada radiação de fundo, que varia em função do local e na maioria dos casos não afeta a saúde de forma significativa.
-> As formas de alotropia do fósforo mais conhecidas são o fósforo vermelho (P), que se forma quando o fósforo branco entra em radiação e o fósforo branco (P4 ) é muito reativo.
A radioatividade
- O fenômeno da radioatividade:
- Rutherford fez o seguinte experimento:

Todas as partículas com carga elétrica positiva reunidas em um pequeno volume. Mesmo com a força de repulsão, grande parte dos núcleos se mantém estável indefinidamente, mas em alguns a força de repulsão que os prótons mantém uns sobre os outros supera a força que faz que continuem unidos, ocorrendo a ejeção de fragmentos do núcleo, ou emissão radioativa, processo conhecido como decaimento, após o decaimento os núcleos se tornam mais estáveis.
- Emissão de radiação alfa: a emissão de partículas alfa modifica o núcleo de um átomo, transformando-o em um átomo de outro elemento químico, processo chamado de transmutação. Quando um átomo emite uma partícula alfa, seu número atômico e sua massa são modificados.
- Emissão de radiação beta: uma partícula equivale a um elétron, quando ocorre a sua emissão, origina-se mais um próton no núcleo, ou seja, o elemento químico transforma-se em outro.
-> Leis da radioatividade:
Conhecendo a natureza das partículas alfa e beta emitidas, pode-se prever o tipo de alteração que acontece no núcleo do átomo de um elemento químico radioativo com base no número e no tipo de partículas que são emitidas, esse pensamento foi proposto por Frederick Soddy e Kasimir Fajans, nas leis da radioatividade.
- Emissão de radiação: a emissão de raios gama é feia pelo núcleo, em geral, com emissão de partículas alfa ou beta. A radiação gama é um tipo de onda eletromagnética. Depois da emissão de partículas alfa ou beta, os núcleos podem estar em um arranjo instável, mas para conseguir um estado mais estável os prótons e nêutrons se rearranjam, e o núcleo libera o excesso de energia como radiação gama. Quando essa radiação é emitida, o número de massa e o número atômico continuam constantes.
- Séries de decaimento radioativo e meia-vida:
OBS: a atividade de uma amostra de material radioativo é caracterizada por determinada taxa de desintegrações por unidade de tempo, mas mesmo assim, quantidades significativas de radiação podem continuar presentes.
Aplicações tecnológicas da radioatividade
- As emissões radioativas e a interação com a matéria:
- Radioatividade e medicina:
- A radioterapia é um tratamento que
usa a radiação ionizante para danificar
o DNA das
células, destruindo o tumor ou impedindo a multiplicação das células
cancerígenas. Em
células normais, pode ocorrer a recuperação do DNA, já em células tumorais, no
entanto, essa capacidade de recuperação é menor. Normalmente, ao final do
tratamento, as células normais recuperam-se.
- Usinas nucleares:
- Bombas nucleares:
-> Aceleradores de partículas: a fusão nuclear também acontece no interior do Sol e aqui na Terra em instalações chamadas aceleradores de partículas. Através dessas instalações foi possível criar artificialmente novos elementos químicos, que possuem síntese importante.
- Rejeitos nucleares:
A reelaboração do modelo de Rutherford
- Espectros atômicos:
- Os vapores originados através de substâncias purificadas produziam um espectro com linhas ou raias de várias cores, separadas por regiões escuras, diferente do espectro originado pela luz solar em que as cores aparecem de forma contínua.
- O espectro eletromagnético: a luz é um tipo de radiação eletromagnética. Todas as radiações eletromagnéticas de diferentes comprimentos de onda e frequências, constituem o espectro eletromagnético.


OBS: o espectro formado pela luz emitida por átomos isolados aquecidos possui traços de cores diferentes e separados uns dos outros, sendo denominado espectro descontínuo.
- A espectroscopia abre novos caminhos: cada elemento químico emite um espectro descontínuo. Bunsen e Kirchhoff elaboraram um método para diferenciar os elementos químicos, levando a descoberta de novos elementos químicos.
-> A espectroscopia permitiu a investigação da composição das estrelas e evidenciou uma limitação no modelo atômico de Rutherford.
- O modelo atômico de Bohr:
- Em vez de um número infinito de órbitas, existe um número limitado de órbitas nas quais um elétron pode se situar, sendo denominado estado estacionários ou níveis de energia.
- Um elétron está em movimento, em certa órbita, com energia constante. Quanto mais longe do núcleo maior é a sua energia.
- Quando um elétron ganha energia, salta para uma órbita mais externa do átomo. Ele pode adquirir energia por aquecimento, corrente elétrica etc.
- Quando um elétron perde energia adquirida, retorna a uma órbita mais próxima do núcleo, que é dissipada na forma de radiação eletromagnética.
- A quantidade de energia absorvida ou liberada por um elétron ao mudar de órbita, relaciona-se à diferença entre os níveis de energia dessas órbitas. Órbitas possíveis, existem somente alguns valores de energia possíveis, sendo chamada de quantizada.
- O modelo atômico quântico esclarecia o comportamento de emissão de luz dos átomos da seguinte forma: o espectro de emissão de certo elemento químico é descontínuo. No experimento de Kirchhoff e Bunsen, a energia fornecida pela chama do bico de Bunsen é suficiente para excitar os elétrons dos átomos de certo elemento químico a uma órbita de maior energia, ou seja, a uma órbita mais longe do núcleo atômico. Como a energia absorvida está relacionada exatamente à diferença de energia entre as órbitas de transição do elétron, diz-se que a energia é quantizada. Ao retornarem a seus estados fundamentais, os átomos liberam a energia em forma de radiação eletromagnética. Quando a radiação atravessa o prisma, ela é decomposta em certo número de linhas espectrais, em que cada linha representa a transição de órbita de um elétron, com energia bem definida.Cada órbita no modelo de Bohr é definida por um número inteiro que vai de um até o infinito, sendo denominado número quântico principal.
- Cores do espectro de emissão:
OBS: quando os átomos de um elemento químico são submetidos à chama, a cor percebida pela visão humana é uma mistura de todas as cores observadas no espectro de emissão.
Configuração eletrônica:
- O modelo de Lewis e sua representação:
- A distribuição eletrônica por camadas ou níveis de energia:
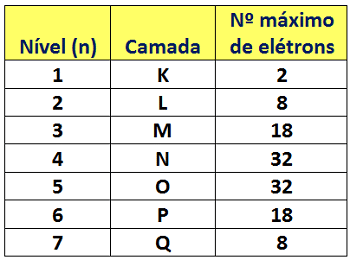
OBS: essa regra possui exceções, principalmente para os elementos químicos de transição. Existe um padrão para a configuração eletrônica: o número de camadas eletrônicas é constante em cada período. Além disso, o número de elétrons de valência é o mesmo para todos os elementos químicos em cada grupo. Isso se traduz na valência, ligada aqui à carga do íon.
Ex: os íons originados pelos elementos químicos do grupo 1 são monovalentes.
- Configuração eletrônica de íons e valência: quando um átomo ganha ou perde elétron, torna-se um íon. Quando um átomo de sódio perde seu elétron de valência ele se torna um cátion sódio com propriedades diferentes do átomo de sódio que lhe formou. A última camada do cátion originado passa a ser a camada L, com oito elétrons. De modo parecido, quando o átomo de oxigênio ganha dois elétrons, ele se transforma no ânion óxido, com propriedades diferentes do átomo de oxigênio de origem. Sua camada de valência também passa a possuir oito elétrons. A presença de oito elétrons na última camada dos íons está de acordo com as regras propostas por Lewis e Langmuir, e é comum a maioria dos íons originados. Esse fato é chamado de regra do octeto e auxilia na determinação da configuração eletrônica e da valência dos íons. O número de elétrons de valência está ligado às propriedades semelhantes apresentadas pelas substâncias constituídas pelos elementos químicos de um mesmo grupo da tabela periódica, mas esse modelo possui limitações, mesmo assim, ele permite a previsão de fenômenos.
Os subníveis e os orbitais:
- Os subníveis de energia e a distribuição eletrônica:
- Diagrama das diagonais ou diagrama de Pauling:

- Os elementos químicos representativos são aqueles em que o elétron mais enérgetico entra no subnível s ou p. Nos elementos químicos de transição, o elétron mais energético entra no subnível d ou f.
- Distribuição em subníveis de energia para íons: quando o átomo recebe ou cede elétrons, ocorrem alterações na camada de valência, que é o nível mais longe do núcleo.
- A dualidade onda-partícula:
- O princípio da incerteza: Heisenberg propôs o princípio da incerteza, no qual quanto maior for a exatidão de uma medida experimental em relação ao elétron, menor será a exatidão de outra medida.
- Orbitais e números quânticos: Erwin Schrödinger elaborou uma equação matemática que descrevia o átomo de hidrogênio de acordo com a hipótese de De Broglie. Suas soluções são conhecidas como funções de onda e são representadas pela letra grega psi (Ѱ). Max Born acreditava que a função de onda poderia estar relacionada à densidade de probabilidade eletrônica ( os elétrons não estão distribuídos em orbitais, no qual é mais provável encontrar um certo elétron). A cada função de onda está relacionado um valor e como apenas certas funções de onda são permitidas, a energia do elétron é quantizada. Para descrever cada órbita, Bohr usa um único número inteiro chamado número quântico, mas para descrever um orbital são necessários três. Os números quânticos orbitais não são valores aleatórios, que aparecem como resultado das operações relacionadas ao modelo de Schrödinger. Wolfgang Pauli chamou de princípio da exclusão: dois elétrons quaisquer não podem ter o mesmo conjunto de números quânticos, ou seja, cada orbital está associado a no máximo dois elétrons.
Nenhum comentário:
Postar um comentário